Forschungsschwerpunkte
Unsere Forschung konzentriert sich auf mikrogliale Dysfunktion und Veränderungen neuronaler und glialer Signale, die zur Pathogenese neurodegenerativer Funktionsstörungen wie der Alzheimer-Demenz (AD), Niemann-Pick Typ C (NPC) und der Frontotemporalen Lobären Degeneration (FTLD) beitragen. Ein besseres Verständnis der zellspezifischen, pathologischen Veränderungen und der Wechselwirkungen zwischen verschiedenen Gehirnzellen wird uns dabei helfen, neue Therapieziele für medizinische Eingriffe aufzudecken.
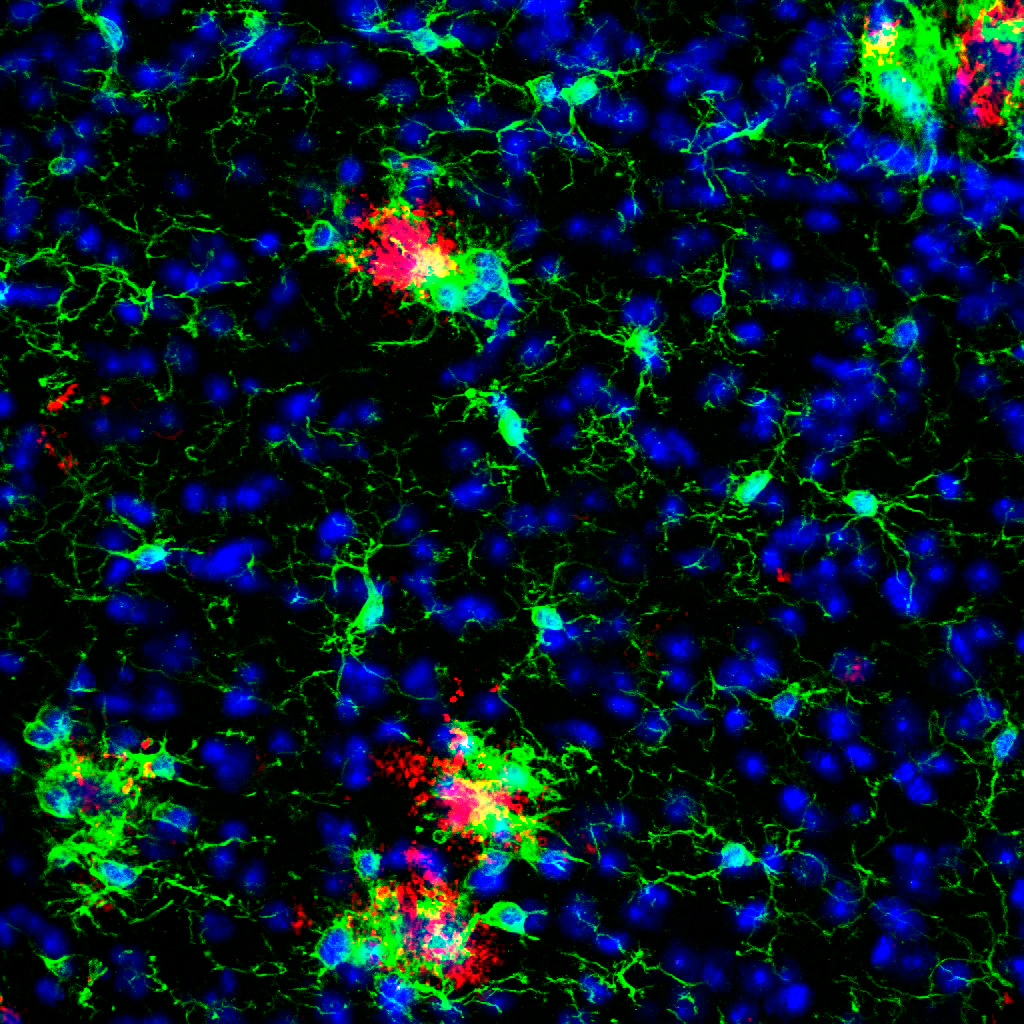
Die Mikrogliazellen-Aktivierung ist ein charakteristisches pathologisches Merkmal der Neurodegeneration. Es wird vermutet, dass in der AD die Beseitigung von ß-Amyloid-Ablagerungen durch Mikroglia beeinträchtigt wird. Um den Beitrag der Mikrogliazellen zur Amyloid-Plaque-Belastung zu untersuchen, haben wir ein neuartiges ex vivo Modell (Gehirn in einer Petrischale) entwickelt, bei dem wir organotypische Hirnschnitte aus gealterten, Amyloid-tragenden Mäusen zusammen mit organotypischen Hirnschnitten von jungen Wildtyp-Mäusen kultivieren. Das Co-Kultur-Paradigma oder nur die Stimulation alter AD-Mikroglia mit löslichen Faktoren junger Mikroglia reichte aus, um ihre phagozytäre Kapazität zu „verjüngen“ und eine Beseitigung des Amyloid-Plaques auszulösen. Unser Ziel ist es, Substanzen zu identifizieren, die AD-Mikroglia beauftragen sollen, Amyloid zu beseitigen und zu verstehen, wie die mikrogliale Immunmodulation zur Milderung der Neuropathologie eingesetzt werden kann. Es wird eine zukünftige Herausforderung sein, die positiven Reaktionen von Mikroglia, wie z. B. Phagozytose, therapeutisch zu verbessern, um die AD zu mildern.
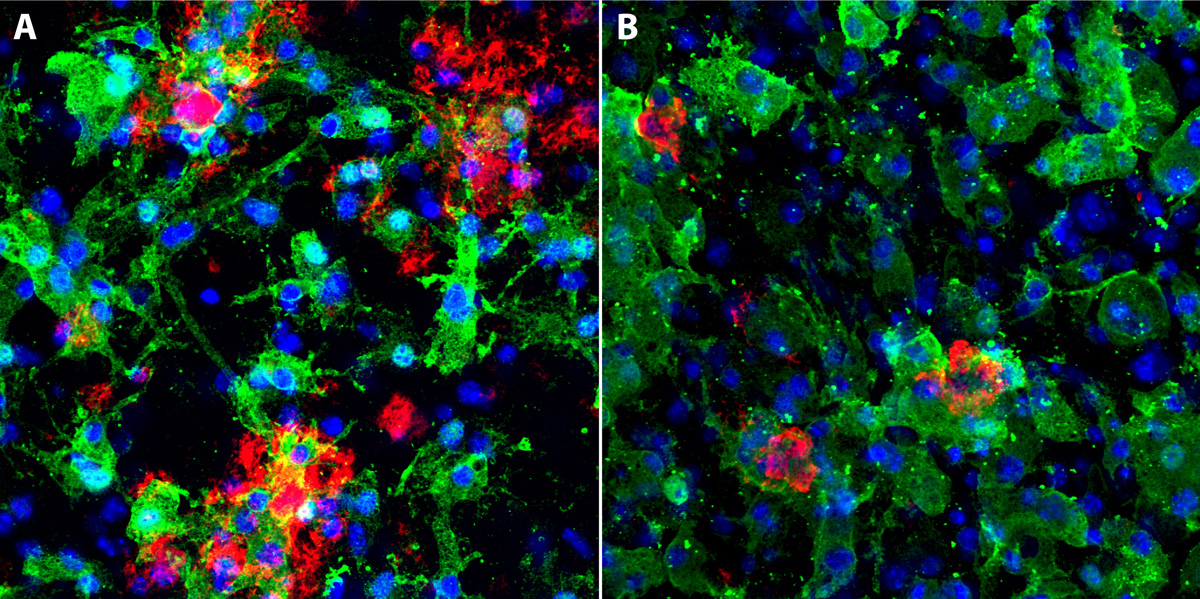
Über AD hinaus, wird der mikrogliale Beitrag bei anderen neurodegenerativen Erkrankungen wie FTLD und NPC wahrgenommen. Diese Krankheiten sind aufgrund gemeinsamer Mechanismen zwischen lysosomalen Speicherkrankheiten und Neurodegenerationen für unsere Forschung von besonderem Interesse. NPC ist eine lysosomale Speicherkrankheit, die aufgrund vieler gemeinsamer pathologischer Merkmale auch jugendliche AD genannt wird, da sie vor allem Kinder und junge Erwachsene betrifft. Unser Forschungsziel ist die Charakterisierung der mikroglialen Dysfunktion und die Analyse von häufig vorkommenden und krankheitsspezifischen, molekularen Veränderungen bei AD, FTLD und NPC.
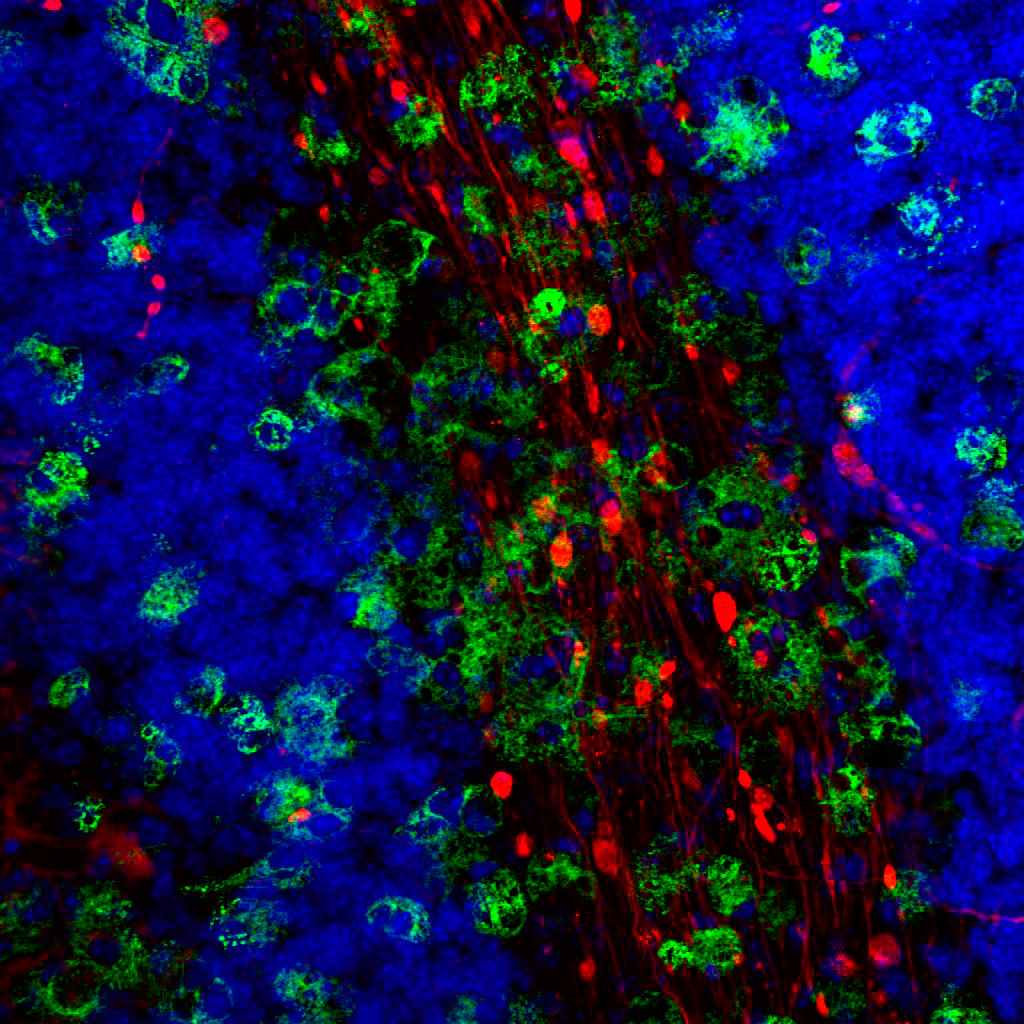
Wir kombinieren unsere Expertise in der Isolierung und Charakterisierung von Primärzellen (Neuronen, Astrozyten, Mikroglia und organotypische Hirnschnitte) mit in vivo Ansätzen (transgene Mausmodelle der Neurodegeneration), um komplexe pathologische Veränderungen verschiedener Gehirnzellen aufzuklären. Mit Hilfe von zellbiologischen, biochemischen, immunhistochemischen und proteomischen Analysen untersuchen wir den Beitrag Zelltyp-spezifischer Veränderungen zu Beginn und während des Verlaufs der Erkrankung, mit dem Endziel, potenzielle Angriffspunkte für die Behandlung dieser zerstörerischen neurodegenerativen Erkrankungen zu identifizieren.

