Forschungsschwerpunkte
Alle Tiere bilden Erinnerungen, um ihr Verhalten kontextabhängig anzupassen. Mit zunehmendem Alter wird die Bildung neuer Erinnerungen jedoch weniger effizient. Während die synaptische Plastizität die Gedächtnisbildung fördert, blieb die Ätiologie der altersbedingten Gedächtnisbildung (AMI) rätselhaft. Um die Herausforderungen zu bewältigen, die mit der Entwirrung der ursächlichen Faktoren der AMI von adaptiven/protektiven Veränderungen während des Alterns verbunden sind, verwendet die Sigrist-Gruppe ein olfaktorisches Konditionierungsparadigma bei Drosophila. Das ermöglicht es ihnen, eine mechanistische Analyse hochkonservierter, neuronaler Schaltelemente mit einem effizienten, genetischen und zellbiologischen, experimentellen Zugang zur Erforschung von Alterung und Gedächtnis zu kombinieren.
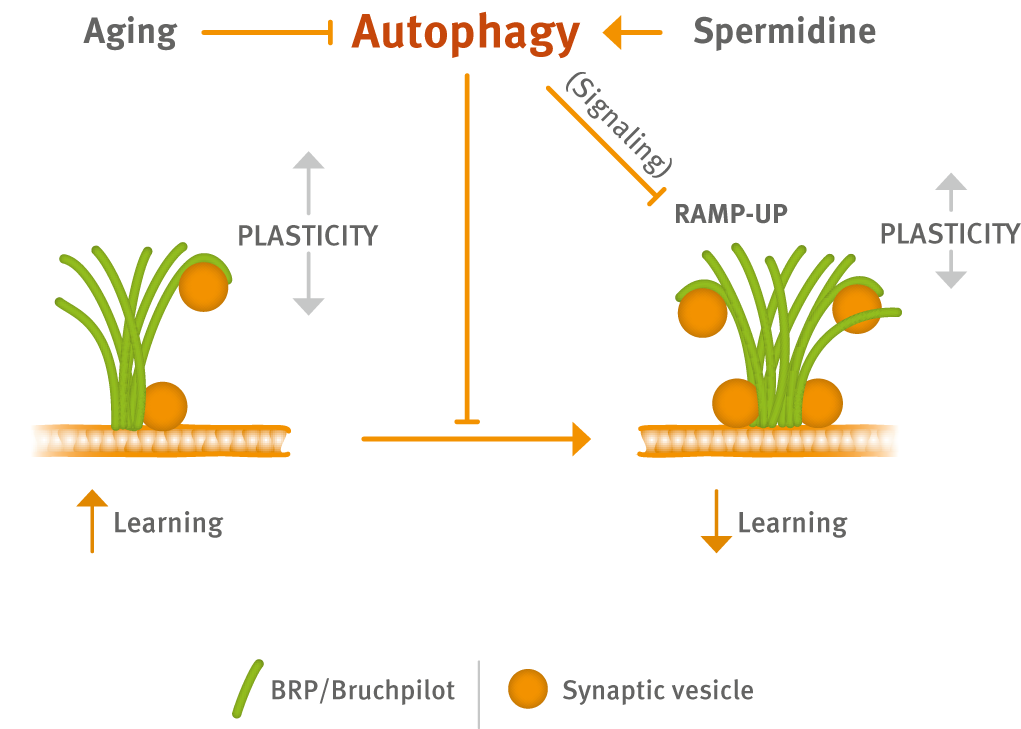
Frühere Arbeiten des Sigrist-Labors zeigten, dass die pharmakologische und genetische Wiederherstellung der Autophagie vor altersbedingter Gedächtnisschwäche bei Drosophila schützt (Gupta et al., 2013). Darüber hinaus zeigten sie kürzlich, dass die Wiederherstellung der Autophagie direkt auf synaptischer Ebene funktioniert und Synapsen in einem funktionsfähigen Raum gehalten werden, der mit der Bildung von Langzeitgedächtnissen kompatibel ist. Die Wiederherstellung der Autophagie tritt der normalerweise auftretenden Aufwärtsverschiebung der präsynaptischen Struktur und Funktion entgegen (Gupta et al., 2016). Wie sich mechanistisch autophagische Regulationen mit synaptischen Plastizitätsmechanismen überschneiden, bleibt eine interessante jedoch z. Z. noch ungeklärte Frage. Ihre vorläufigen Ergebnisse implizieren nun den evolutiv hoch konservierten NPY-Signalweg in der Kommunikation zwischen dem autophagischen Status und der synaptischen Plastizität in einer nicht-zellautonomen Weise.
Sie stellen fest, dass i) die genetische Beeinträchtigung der Autophagie bereits bei jungen Tieren die synaptischen Veränderungen reproduziert, die normalerweise für gealterte Tiere typisch sind, ii) die defekte Autophagie den NPY-Signalweg schwächt und iii) die genetische Eliminierung des NPY-Signalwegs die alterstypischen synaptischen Phänotypen schon bei jungen Tieren reproduziert. Insbesondere wird vermutet, dass eine Altersmodulation hypothalamischen NPY-Signalgeschehens zu altersassoziierten kognitiven Defiziten beitragen könnte. Diese Ergebnisse bringen den NPY-Signalweg und die autophagische Signalübertragung mit einem gehirnweiten, synaptischen Metaplastizität in Verbindung, die einen vielversprechenden Ansatzpunkt therapeutischer Intervention zur Verbesserung der AMI darstellen könnte. Zukünftige Arbeiten, auch an Nagetiermodellen, in Zusammenarbeit mit den Gruppen Schmitz und Garner, sollen das mechanistische Verständnis von AMI weiter voranbringen. Zur Vorbereitung auf dieses Bestreben, haben wir kürzlich, zusammen mit dem Schmitz-Labor, die präsynaptische Signalübertragung bei Nagetieren an wichtigen Modellsynapsen des Hippokampus charakterisiert (Grauel et al., 2016).