Forschungsschwerpunkte
Der langjährige Schwerpunkt unserer Arbeitsgruppe ist die Erforschung der Mechanismen der Neurodegeneration und der alpha-Synuclein-Toxizität bei der Parkinson Erkrankung (PD). Wir haben eine Vielzahl von experimentellen Modellen entwickelt und charakterisiert und verwenden modernste histologische und molekularbiologische Techniken. Mit Hilfe dieser Methoden untersuchen wir:
- spezifische Mechanismen, die bei der Pathogenese der Neurodegeneration und der Akkumulation/Aggregation von alpha-Synuclein bei der PD eine Rolle spielen; bedeutend sind dabei z. B. die Mitochondrien, der Proteinabbau, die Aktivierung der Mikroglia und der Neuron-zu-Neuron-Transfer von Proteinen;
- auf welche Weise Risikofaktoren der Erkrankung (wie Alterungsprozesse, genetische Varianten und Umwelteinflüsse) den Beginn und das Fortschreiten der PD-Pathologie beeinflussen, und
- die Wirksamkeit neuer therapeutischer Strategien (z. B. RNA-Silencing, Immuntherapie und regenerative Zelltherapie), um den pathologischen Prozessen, die der PD zugrunde liegen, vorzubeugen, zu verlangsamen oder diese aufzuhalten.
Obwohl sich unsere Forschung hauptsächlich auf die PD konzentriert, untersuchen wir auch Mechanismen, welche die PD und andere neurodegenerative Erkrankungen gemeinsam haben. Wir glauben, dass ein besseres Verständnis verschiedener Krankheiten uns dabei helfen wird, zentrale Fragen der Pathogenese zu beantworten, z. B. zu den Mechanismen selektiver neuronaler Vulnerabilität und zu den Bedingungen, die zu klinischer und pathologischer Komorbidität führen.
Konkrete Beispiele
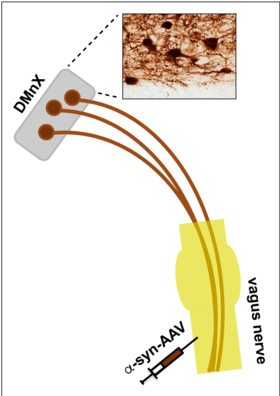
Experimentelle Modelle. Abbildung 1 zeigt eine in unserem Labor entwickelte Strategie zur gezielten Überexpression des alpha-Synuclein-Proteins im dorsalen motorischen Vaguskern (DMnX). Virale Vektoren (AAV), welche die DNA zur Expression von alpha-Synuclein tragen, werden in den Vagusnerv injiziert und gelangen über die Fasern dieses Nervs zu den DMnX-Neuronen und transduzieren diese dort. DMnX-Neuronen, die in der Abbildung gezeigt werden, gehören zu den Nervenzellen, die früh von der alpha-Synuclein-Pathologie während der PD-Entwicklung betroffen sind.
Techniken. Abbildung 2 zeigt Neuronen in der Substantia nigra pars compacta einer Maus, in denen nach in situ Hybridisierung die mRNA, die alpha-Synuclein codiert, grün markiert ist. Die Substantia nigra ist ein primäres Ziel der neurodegenerativen PD-Prozesse und alpha-Synuclein ein Protein mit einer zentralen Rolle bei der Entstehung der PD.
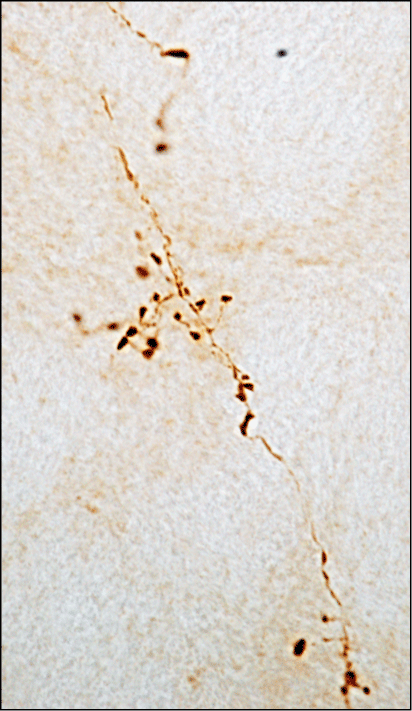
Mechanismen. Abbildung 3 zeigt axonale Fortsätze im Locus coeruleus der Ratte, die mit alpha-Synuclein infolge der Ausbreitung des Proteins von caudalen (Medulla oblongata) in rostrale (Pons) Gehirnregionen angereichert sind. Der Locus coeruleus ist ein pontiner Kern, der besonders anfällig für Neurodegeneration und alpha-Synuclein-Pathologie bei der PD ist. Die Akkumulation von alpha-Synuclein, die eine Folge der Ausbreitung des Proteins ist, könnte eine Rolle bei dieser erhöhten Anfälligkeit spielen.
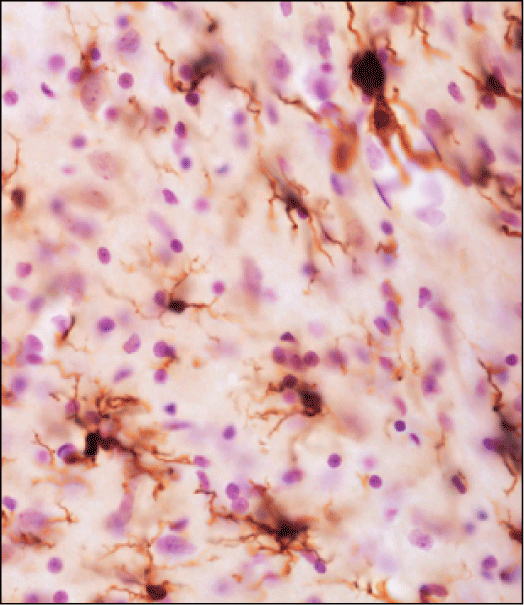
Risikofaktoren. Abbildung 4 zeigt aktivierte Mikrogliazellen im Locus coeruleus von alternden Ratten als Folge der caudo (Medulla oblongata)- rostralen (Pons) Ausbreitung von alpha-Synuclein. Die Aktivierung von Mikrogliazellen könnte das alternde Gehirn besonders anfällig für neurodegenerative Prozesse machen.
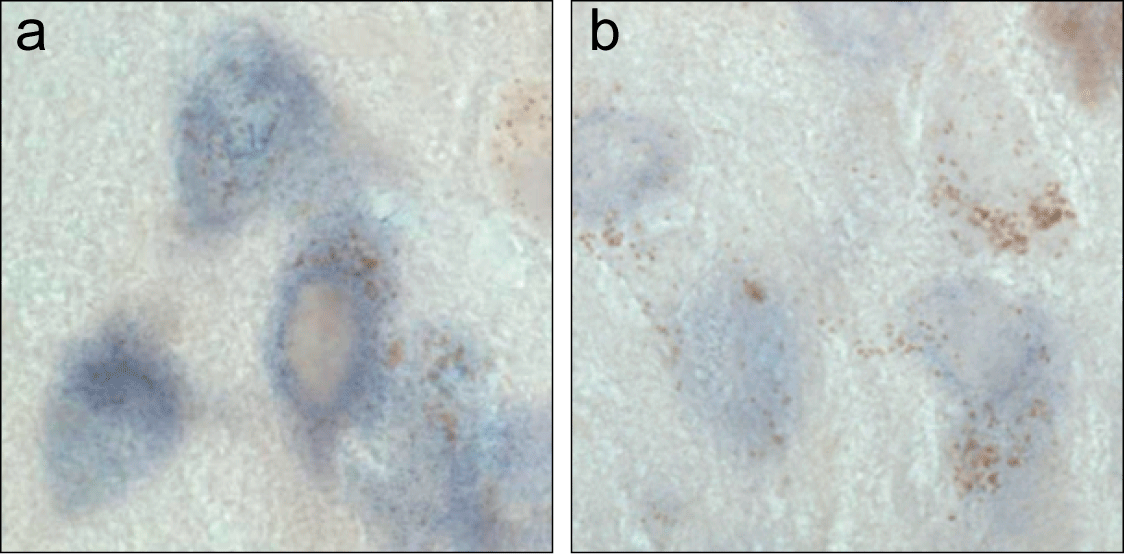
Therapeutischer Strategien. Abbildung 5 zeigt Neuronen der Substantia nigra, in denen nach in situ Hybridisierung die mRNA (lila) markiert ist, die alpha-Synuclein codiert. Normale Neuronen (a) werden mit Neuronen verglichen, die mit „small interfering RNA“ (gegen alpha-Synuclein) behandelt wurden (b). Eine Reduktion der lila Markierung in (b) weist auf eine verringerte Expression von alpha-Synuclein hin und deutet daraufhin, dass RNA-Interferenz genutzt werden könnte, um Neuronen vor der Toxizität von alpha-Synuclein zu schützen.