Defekte Schleusen stören Hirnentwicklung
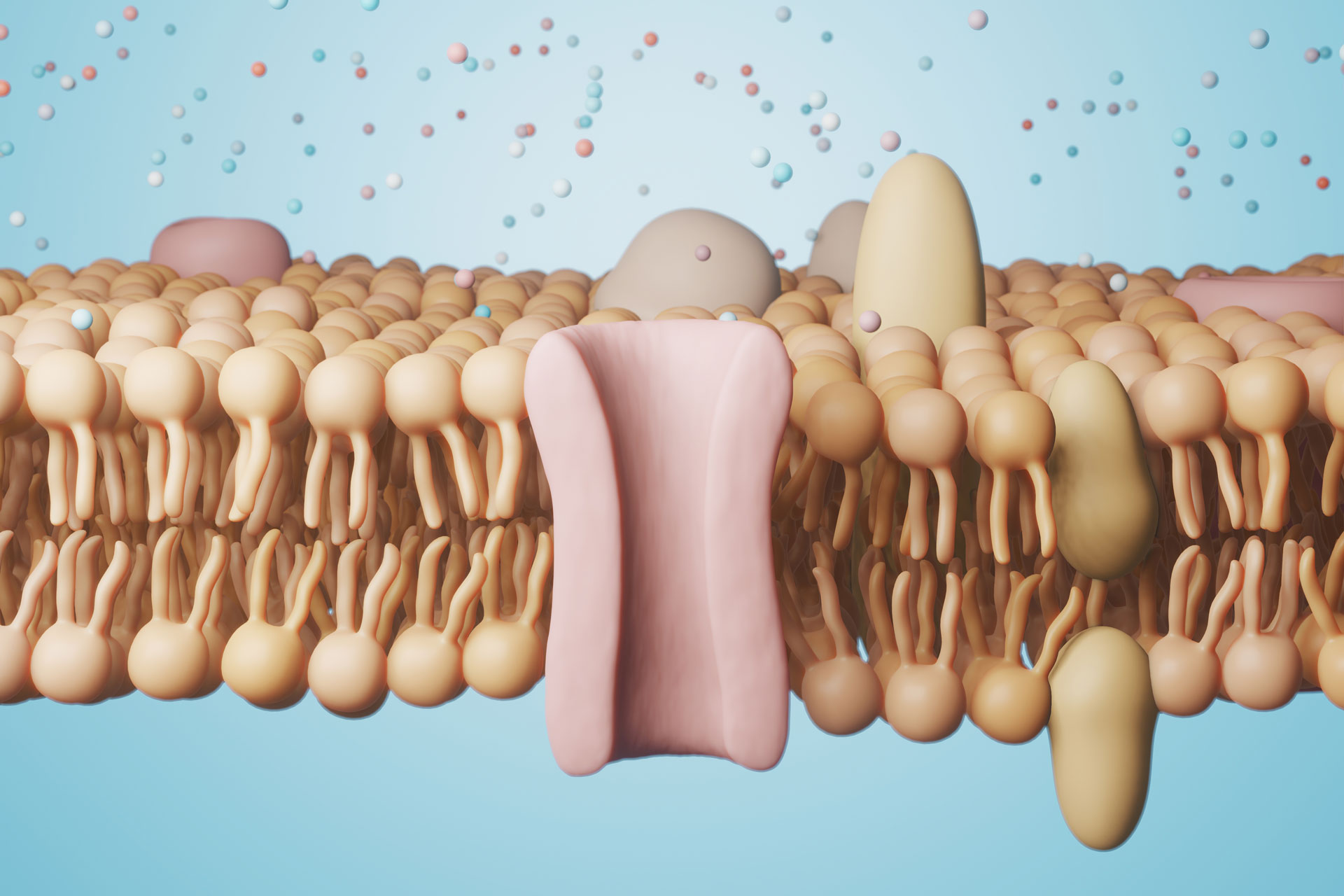
Fehlerhafte Poren in der Zellmembran behindern die Zellteilung und die Reifung des Nervensystems während der Embryonalentwicklung – was zu verringertem Hirnvolumen und neurologischen Störungen führen kann. Forschende des DZNE, der Uniklinik Köln und des Zentrums Molekulare Medizin der Universität zu Köln berichten darüber in der Fachzeitschrift PNAS. Ihre Befunde, die auf Studien an Mäusen und Zellkulturen beruhen, geben Einblicke in grundlegende Prozesse, die in ähnlicher Weise auch für den Menschen gelten könnten.
„Während der Embryonalentwicklung gibt es kritische Phasen. Das gilt insbesondere für die Entwicklung des Nervensystems. Wenn in diesen Stadien etwas schiefläuft, hat das schwerwiegende und dauerhafte Folgen“, so Dirk Isbrandt, Forschungsgruppenleiter am DZNE und Professor für Experimentelle Neurophysiologie an der Universität zu Köln. Wie die aktuelle Studie zeigt, spielen dabei sogenannte HCN-Kanäle – winzige Poren in der Zellmembran – eine wichtige Rolle. „Wenn diese Kanäle verstopft sind, wird der Zellzyklus gestört. Das haben wir in unseren Untersuchungen herausgefunden. Neurale Stammzellen können sich dann nicht normal teilen und vermehren. Das bedeutet, dass sie sich nicht in dem Ausmaß zu Nervenzellen fortentwickeln, wie es der Fall sein sollte. Bei Mäusen führte dies zu Mikrozephalie, also verringertem Hirnvolumen“, so Prof. Isbrandt.
HCN-Kanäle bestehen aus speziellen Proteinen, die eine molekulare Pipeline formen. Diese Konstrukte fungieren als Pforten: Ihr Öffnen und Schließen verändert den Einstrom von Natrium-Ionen in die Zelle. Dieser Ladungsfluss beeinflusst das sogenannte Membranpotenzial, eine elektrische Spannung, die sich über die Zellmembran aufbaut und sich bei normaler Zellteilung in bestimmter Weise verändert. Fachleute sprechen von „Depolarisation“. Doch sind die HCN-Kanäle blockiert, kann der Ladungstransport durch die Zellmembran nicht stattfinden. Die Wissenschaftlerinnen und Wissenschaftler konnten diesen Effekt bei Mäusen mit gentechnisch verändertem Erbgut nachvollziehen. In diesen Tieren waren – infolge eines modifizierten Gens – die Proteine, die einen HCN-Kanal bilden, in einer Weise verändert, dass der Durchgang dauerhaft geschlossen war. Zusätzlich führte das Team um Isbrandt Untersuchungen an Zellkulturen durch.
Bislang unbekannter Mechanismus
HCN-Kanäle kommen aber auch im menschlichen Organismus vor, insbesondere im Gehirn und in Zellen des Herzmuskels. Dort ist ihre Funktion gut erforscht – über ihre Rolle während der Embryonalphase weiß man wenig. „Man kennt Patienten mit Epilepsie und Genmutationen, die bewirken, dass die HCN-Kanäle nicht richtig funktionieren. Manche dieser Menschen haben eine Mikrozephalie. Unsere Studie legt die Vermutung nahe, dass die Ursachen dafür in einer gestörten Zellteilung während der Embryonalentwicklung liegen“, sagt Isbrandt. „Sicherlich bilden unsere Untersuchungen die Situation im Menschen nur grob nach. Dennoch gehen wir davon aus, dass wir auf einen bislang unbekannten Mechanismus für Fehlbildungen des Gehirns gestoßen sind. Das ist von grundsätzlicher Bedeutung für das Verständnis der Entwicklung des Nervensystems.“
Originalveröffentlichung
Developmental HCN channelopathy results in decreased neural progenitor proliferation and microcephaly in mice.
Anna Katharina Schlusche et al.
PNAS (2021).
DOI: 10.1073/pnas.2009393118
September 2021
