Forschungsschwerpunkte

Der Zebrafish ist ein kleiner Süßwasserfisch bestens geeignet für genetische Studien. Die Fische sind hervorragend zur Zucht im Labor geeignet und ein Zebrafisch Weibchen kann pro Woche hunderte Eier legen.
Die Zebrafisch Embryonen und Larven sind durchsichtig und bieten dadurch ideale Voraussetzungen zur Funktionsanalyse von Krankheitsgenen, nicht invasiver in vivo Bildgebung und Therapiestudien. Die Forschungsgruppe Zebrafisch Modelle verwendet den Zebrafisch um die Funktion von Krankheits-assoziierten Genen zu identifizieren und die molekularen Mechanismen neurodegenerativer Erkrankungen wie Alzheimer (AD), Amyotrophe Lateralsklerose (ALS) und Frontotemporale Lobare Degeneration (FTLD) zu entschlüsseln. Mittels modernem CRISPR/Cas9 Genom Editierung werden Zebrafisch Mutanten generiert, Proteine verändert oder Mutationen die zur Krankheit führen in das Genom eingeführt. Das Zebrafisch Modelle Labor war eines der ersten Labore die diese Technologie im Zebrafisch erfolgreich angewendet hat (Hruscha et al., Development 2015). Der wissenschaftliche Fokus der Gruppe liegt bei der Analyse RNA-bindender Proteine in ALS und der Analyse der physiologischen Funktion der AD-assoziierten Proteine BACE1 und -2 und dem Amyloid Vorläufer Protein (APP).
Die große moderne Zebrafisch Tierhaltung und das Knowhow der Zebrafisch Modelle Gruppe stehen als Technologie Plattform für kollaborierende Gruppen innerhalb des DZNE zur Verfügung.
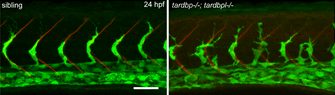
Die transparenten Zebrafisch Larven erlauben es uns in das Innere des intakten Organismus zu schauen. Durch das markieren bestimmter Zelltypen können wir so diese sichtbar machen und die Interaktion verschiedener Zellen im lebendigen Organismus verfolgen. In dem unteren Beispiel haben wir die Blutgefäße mit einem grün fluoreszierenden Farbstoff markiert und können so die Entwicklung des Blutgefäßsystems live verfolgen.
In diesem Beispiel vergleichen wir Zebrafische, denen ein funktionelles TDP-43 Gen fehlt (eine Gen bei dem Mutationen in ALS Patienten vorliegen und das in fast allen Fällen von ALS aggregiert) zeigt ein drastische Fehltentwicklung (hier in grün dargestellt – rechts in Mutanten verglichen mit den wildtyp Fischen links). Die Analyse von mutanten TDP-43 Fischen zeigte diesen unvorhergesehenen Zusammenhang zwischen Neurodegeneration und dem Blutgefäßsystem auf. Die molekulare Grundlage dieser Fehlentwicklung konnte entschlüsselt werden und auch in Patienten nachgewiesen werden. Diese TDP-43 Zielmoleküle können alternative Strategien zur Therapie von ALS aufzeigen.
Durch die Untersuchungen der Genfunktion von Krankheitsgenen sowie der Auswirkungen von Kranksheits-assoziierten Mutationen auf den Gesamtorganismus trägt die Zebrafisch Modelle Gruppe wesentlich zum allgemeinen Verständnis der molekularen Mechanismen der Krankheitsentstehung bei.