Forschungsschwerpunkte
Warum wirkt sich eine bestimmte Neuropathologie nicht in gleicher Weise auf alle Neuronen desselben Typs aus? Dies ist eine faszinierende Frage in der Neurodegenerationsforschung, die unbeantwortet bleibt und den Schwerpunkt meines Labors darstellt.
Bei den meisten neurodegenerativen Erkrankungen degenerieren bestimmte neuronale Untergruppen schnell, während andere, die - wenn überhaupt - die gleichen Mutationen tragen, theoretisch analogem Stress ausgesetzt sind und vergleichbare funktionelle Eigenschaften aufweisen, auch in den letzten Stadien der Erkrankung unberührt bleiben. Motoneuronerkrankungen sind eine Gruppe von Erkrankungen, bei denen Motoneuronen (MNs) des Rückenmarks und / oder der Motorkortex der primär betroffene Zelltyp sind, bei denen dieses verwirrende Merkmal ebenfalls beobachtet werden kann. Unter Verwendung einer Vielzahl von Ansätzen, die von zellbiologischen Techniken über Live-Imaging bis hin zu Genomeditierung und Einzelzellgenomik reichen, und unter Verwendung von hiPSC zusammen mit transgenen Tiermodellen, untersuchen wir die molekularen Mechanismen, die einem solchen selektiven MN-Tod zugrunde liegen. Besonderes Augenmerk legen wir auf die Erforschung der molekularen Grundlagen des Proteostase-Versagens – eine der wichtigen Ursachen bei der Neurodegeneration - und auf die Untersuchung des Beitrags von zellautonomen und nichtzellautonomen Faktoren zum selektiven MN-Verlust. Unser letztendliches Ziel ist es, den molekularen Ursprung dieser ausgeprägten neuronalen Anfälligkeit zu verstehen, um wirksame Therapeutika zu entwickeln, die auf bestimmte neuronale Subtypen oder Phasen der Krankheit abzielen.
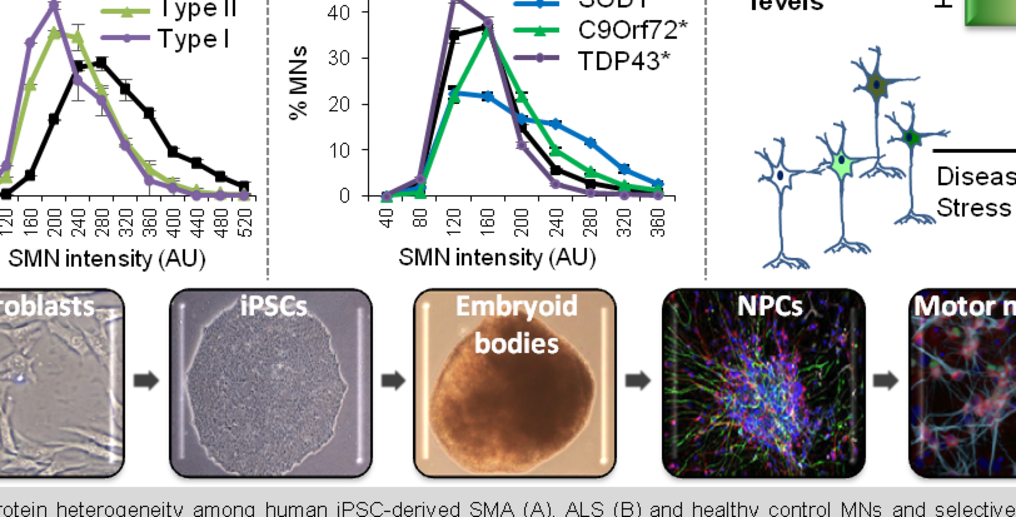
Dieser Schlüsselaspekt des selektiven Todes von Motoneuronen bei Motoneuronerkrankungen war mit verfügbaren Mausmodellen nur schwer zu behandeln. Wir verwenden als Hauptmodellsystem einen Ansatz basierend auf humanen induzierten pluripotenten Stammzellen (iPSC) und haben festgestellt, dass MNs selbst innerhalb eines einzigen genetischen Hintergrunds eine große Vielfalt von SMN-Leveln aufweisen, die für das Überleben von MN essentiell sind, und dass jene Zellen mit niedrigen SMN-Leveln anfälliger sind zu sterben. Diese Korrelation gilt für MNs, die Mutationen exprimieren, die die häufigsten Motoneuronerkrankungen verursachen (Amyotrophe Lateralsklerose oder ALS und spinale Muskelatrophie oder SMA), und sogar für MNs, die von nicht betroffenen Patienten erhalten wurden. Diese Entdeckung führte zu einem neuen Verständnis der Bedeutung der Zellvielfalt für das Fortschreiten dieser Krankheiten und half zu erklären, warum es eine "überlebende" Population von MN gibt. Es gibt jedoch so viel, dass wir es immer noch ignorieren. Einige der Fragen, die wir beantworten möchten, lautet: Was sind die Hauptähnlichkeiten und -unterschiede zwischen den überlebenden ALS- und SMA-MNs? Gibt es gemeinsame Faktoren bzw. Signal- oder Stoffwechselwege die von allen neuronalen Typen, die bei MNDs nicht betroffen sind, geteilt werden und die ihren Schutz erklären? Was ist die molekulare Basis der SMN-Heterogenität zwischen MN-Populationen? Und schliesslich: Warum degenerieren viele Neuronen, während einige vollständig resistent bleiben?

