Die detaillierte dreidimensionale Struktur des Transport-Proteins TSPO eröffnet neue Wege für die Diagnostik und Therapie bestimmter Krankheiten
Gemeinsame Pressemitteilung des DZNE und des Max-Planck-Instituts für biophysikalische Chemie
Bonn/Göttingen, 21. März 2014. Wenn sie das Wort „Cholesterin“ hören, denken die meisten Menschen unvermittelt an zu fettiges Essen, schlechte Blutwerte und Herz-Kreislauf-Erkrankungen. Trotz seines Rufs ist Cholesterin für uns jedoch unverzichtbar: Es stabilisiert die Membranen unserer Zellen und ist Rohstoff für die Produktion verschiedener Hormone in den Kraftwerken der Zelle, den Mitochondrien. Göttinger Forscher haben nun erstmals im atomaren Detail die Struktur des molekularen Transporters TSPO aufgeklärt, der Cholesterin in die Mitochondrien einschleust. Zugleich dient TSPO als Andockstelle für diagnostische Marker und verschiedene Medikamente wie zum Beispiel Valium. Die detaillierten Kenntnisse seiner dreidimensionalen Form und Funktion eröffnen neue diagnostische und therapeutische Perspektiven.
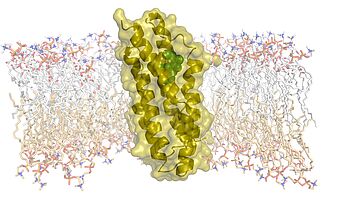
Mitochondrien sind nicht nur der wichtigste Energielieferant der Zelle. Sie stellen auch Steroidhormone wie die Sexualhormone Testosteron und Östradiol her, die viele Vorgänge im Organismus steuern. Ausgangsstoff für die Produktion von Steroidhormonen ist Cholesterin, das zunächst über zwei Membranen in das Innere der Mitochondrien eingeschleust werden muss. Hierfür ist das Transportprotein TSPO in der äußeren Mitochondrienmembran verantwortlich. Welche komplexe dreidimensionale Struktur es bei seiner Arbeit einnimmt, haben jetzt zwei Teams um die Göttinger Forscher Markus Zweckstetter und Stefan Becker mittels Kernspinresonanz (NMR)-Spektroskopie im atomaren Detail aufgeklärt.
Die Forscher schafften diesen methodischen Durchbruch mit einem ausgeklügelten Trick: Für ihre Experimente koppelten sie den Transporter an einen wichtigen diagnostischen Marker namens PK11195. Erst dieser Komplex brachte den Göttinger Wissenschaftlern auswertbare Messergebnisse. Die TSPO-Struktur liefert nicht nur Hinweise, wie Cholesterin in die Mitochondrien hineintransportiert wird. „Wir verstehen nun auch sehr viel besser, wie diagnostische Marker und Medikamente von TSPO erkannt und gebunden werden“, erklärt Zweckstetter, Forschungsgruppenleiter am Deutschen Zentrum für Neurodegenerative Erkrankungen (DZNE), am Max-Planck-Institut für biophysikalische Chemie und Mitglied des Zentrums für Mikroskopie im Nanometerbereich und Molekularphysiologie des Gehirns (CNMPB) der Universitätsmedizin Göttingen.
TSPO wird bereits seit Längerem erfolgreich für die Diagnostik und Therapie verschiedener Krankheiten eingesetzt. „Bei Verletzungen und Entzündungen des Gehirns produzieren Zellen verstärkt TSPO. Diesen Umstand macht man sich in der Diagnostik neurodegenerativer Erkrankungen wie Parkinson oder Alzheimer zunutze“, erläutert der Proteinchemiker und Max-Planck-Forscher Stefan Becker, der mit Zweckstetter Tür an Tür forscht.