Forschungsschwerpunkte
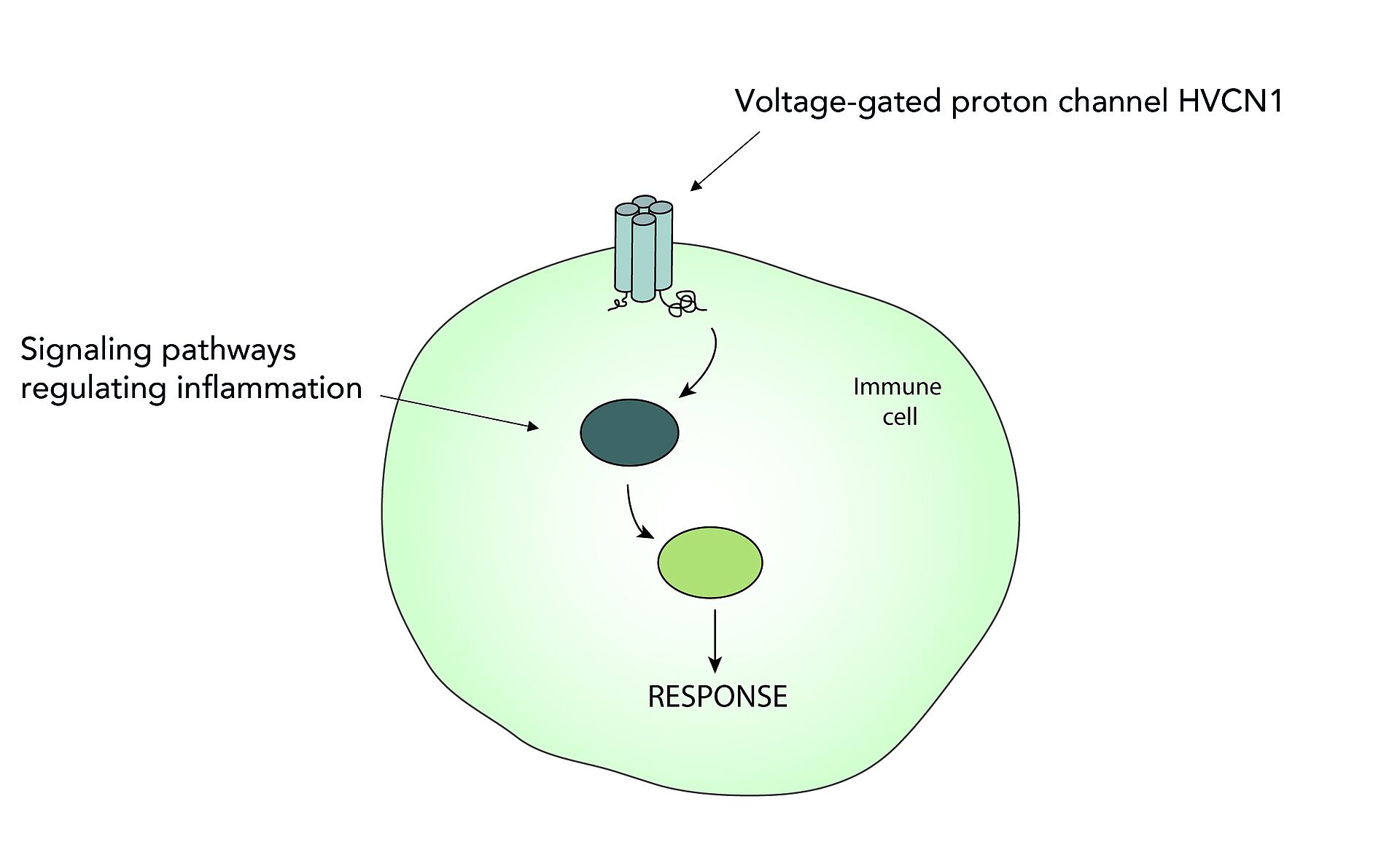
Die Funktion von Immunzellen wird durch eine Vielzahl verschiedener Signalwege reguliert. Meine Gruppe erforscht diese Signalwege und wie sich deren Veränderung auf die Alterung und auf neurodegenerative Erkrankungen auswirken. Insbesondere erforschen wir die Funktion des spannungsgesteuerten Protonenkanals HVCN1 in Immunzellen sowie andere Signalwege, welche Entzündungen in Mikroglia regulieren (Zusammenfassung in Abb. 1).
Die Funktion des spannungsgesteuerten Protonenkanals HVCN1 in Immunzellen
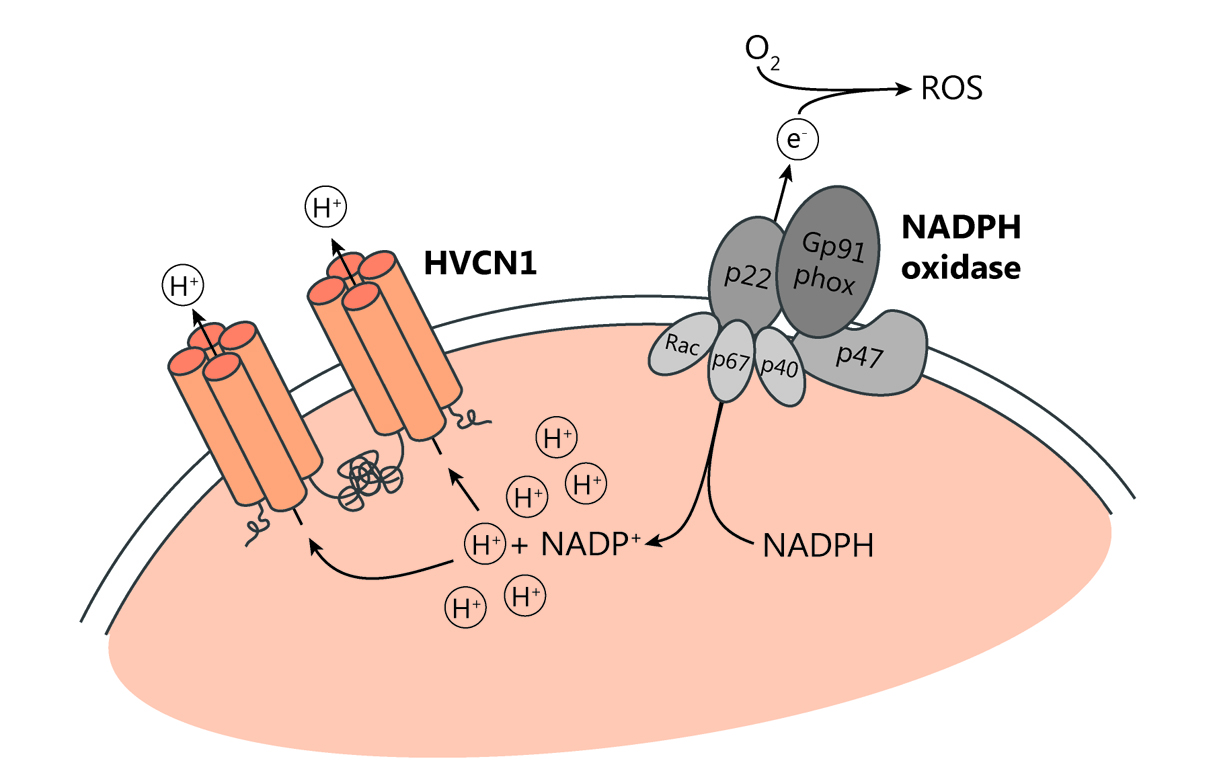
Der spannungsgesteuerte Protonenkanal HVCN1 ist der einzige seiner Art in Säugetieren. Dieser Ionenkanal transportiert Protonen entlang des chemischen Gradienten aus Zellen hinaus und wirkt somit intrazellulärer Übersäuerung und Membrandepolarisation entgegen. Auf diese Weise trägt HVCN1 zur Aufrechterhaltung der Produktion reaktiver Sauerstoffspezies (ROS) durch das Enzym NADPH-Oxidase bei (Abb. 2). Reaktive Sauerstoffradikale wiederum übernehmen wichtige Funktionen wie die Abwehr von Pathogenen oder die Regulation von intrazellulären Vorgängen. Werden sie allerdings in zu hohem Maße produziert, können sie auch die körpereigenen Zellen schädigen.
Wir konnten als Erste die Funktion von HVCN1 bei der Regulierung von B-Zell-Reaktionen beschreiben. In diesen Zellen führt der Verlust des Protonenkanals, und die damit verbundenen verringerte ROS Produktion, zu einer Hemmung des B-Zell-Rezeptor-Signalwegs und damit schlussendlich zu einer stark beeinträchtigten Antikörperantwort (Capasso et al, Nat Immunol, 2010). Außerdem konnten wir eine Spleißvariante von HVCN1 identifizieren, die durch eine Verkürzung des N-Terminus einen verstärkten Protonenfluss aufweist. Interessanterweise wird diese Spleißvariante in hohem Maß in B-Zell-Lymphomen wie der chronischen lymphatischen Leukämie exprimiert (Hondares et al., PNAS, 2014).
Zudem sind wir nun an der Rolle von HVCN1 in myeloiden Zellen, vor allem in Mikroglia und Granulozyten im Kontext der Alzheimer Erkrankung, interessiert. Auch für diese Immunzellen konnte gezeigt werden, dass HVCN1 zur Erhaltung der ROS-Produktion notwendig ist. Allerdings gibt es nur wenige Informationen dazu, wie HVCN1 darüber hinaus die Aktivierung dieser Immunzellen regulieren kann. Deswegen kombinieren wir In-vivo- und In-vitro-Studien, um die Auswirkungen des Verlusts von HVCN1 auf die Alzheimer Erkrankung zu untersuchen und sein Potenzial als therapeutisches Ziel zu bewerten.
Signalwege, die Entzündungen in gealterten Mikrogliazellen regulieren
Mikrogliazellen sind die Immunzellen des Gehirns, sie spielen eine wichtige Rolle bei der neuronalen Zellhomöostase, tragen aber auch zur Krankheitspathologie bei neurodegenerativen Erkrankungen bei. Bei der Untersuchung von Veränderungen der Signalwege in gealterten Mikrogliazellen entdeckten wir eine Hochregulation des mTORC1-Signalwegs, insbesondere seiner Regulation der Proteinsynthese. Tatsächlich synthetisieren gealterte Mikroglia während einer Entzündungsreaktion größere Mengen an Entzündungsmediatoren wie Zytokine und Immunrezeptoren (Keane*, Antignano* et al., JCI, 2021). Die genetische Hemmung des mTORC1-Signalwegs führte zu einer verminderten Entzündungsreaktion aufgrund reduzierter Proteinmediatoren, obwohl ihre mRNA-Expressionsniveaus höher waren. Überraschenderweise schien die mTORC1-Hemmung einen eher spezifischen Effekt auf die Translation der Entzündungsreaktion zu haben als die mRNA-Translation insgesamt. Basierend auf diesen Erkenntnissen untersuchen wir nun die Spezifität der mTORC1-Regulation über das Mikrogliazell-Translatom bei Alterung und anderen entzündlichen Prozessen, die für die Neurodegeneration relevant sind.